热门关键词: ELISA试剂盒 - 大鼠ELISA试剂盒- 小鼠ELISA试剂盒
全国统一客服热线:
0755-28715175
热门关键词: ELISA试剂盒 - 大鼠ELISA试剂盒- 小鼠ELISA试剂盒
全国统一客服热线:
0755-28715175
9游总区生物报道:2024年6月18日,中国科学技术大学生命科学与医学部黄成栋教授团队在Nature Structural & Molecular Biology期刊发表了题为“Structural basis for the dynamic chaperoning of disordered clients by Hsp90”的研究论文。该研究利用液体核磁共振技术,成功解析了首个开放构象的Hsp90与固有无序蛋白底物的复合体结构。这一结构展现了独特的“二分式”结合模式,并进一步揭示了其动态功能机制。这是全球第四个分子伴侣与固有无序蛋白的高分辨复合体结构报道,也是目前通过核磁共振技术解析的最大(约165 kDa)蛋白高分辨复合体结构。
蛋白质是生命组织正常工作的根本所在,而只有经正确折叠的蛋白才能实现其生物功能,否则不仅会造成蛋白功能的异常,更会导致细胞内蛋白的寡聚乃至沉淀,并最终引发多种严重的人类疾病。分子伴侣(Molecular Chaperone)是辅助蛋白正确折叠至适当构象的关键因子,对于维持细胞内蛋白质的健康稳态环境至关重要,因此近年来成为国际研究的热点之一。然而,分子伴侣与底物分子发生相互作用时通常采用高度动态、瞬时、非特异性(promiscuous)的‘若即若离’相互作用模式。这种高度动态的分子间相互作用模式赋予了分子伴侣独特的生物学功能,但也使相关研究面临极大困难。
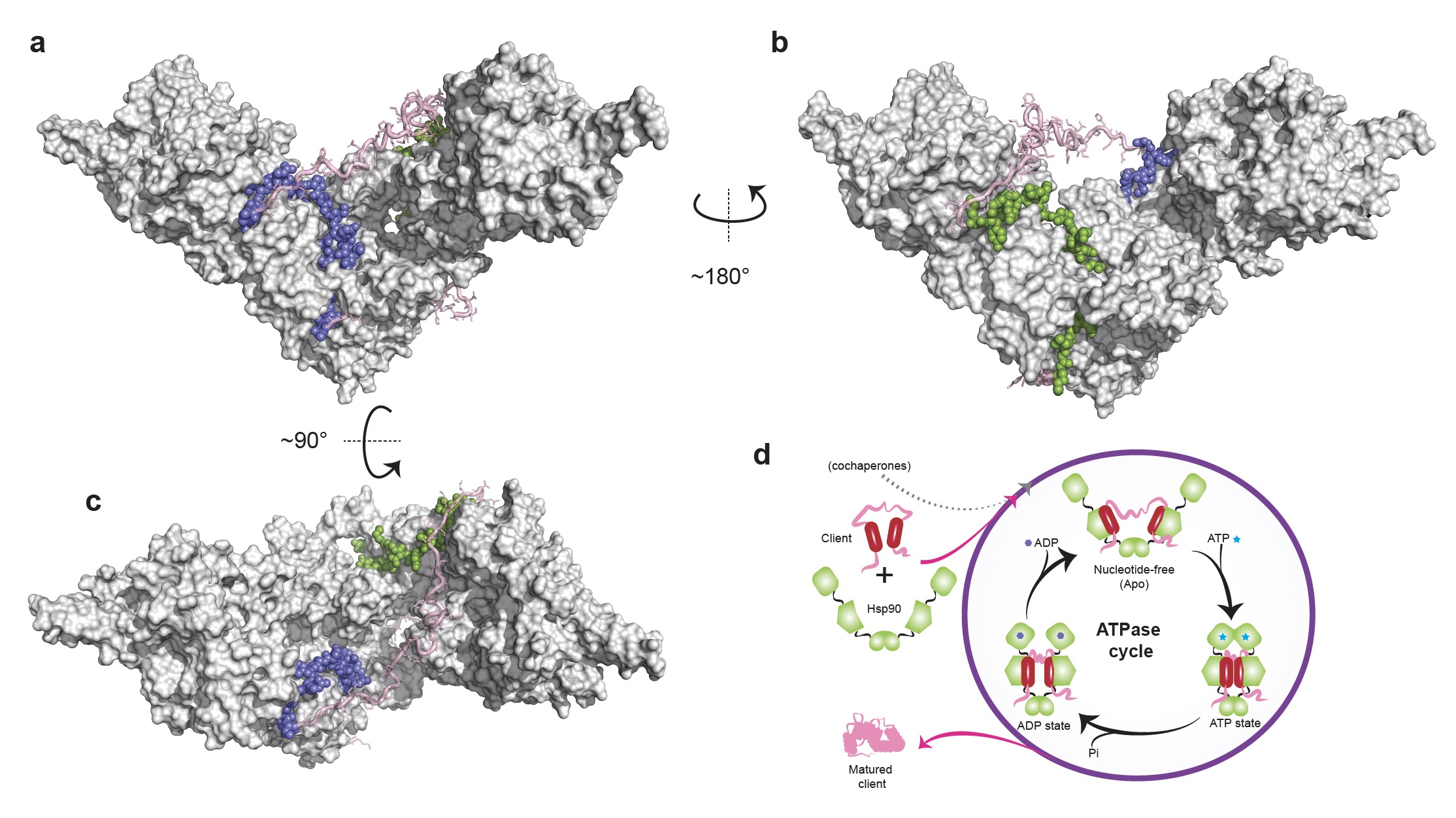
图1. 开放构象的Hsp90与固有无序蛋白的复合体结构及其动态作用机制
分子伴侣热休克蛋白90(Hsp90)被认为是功能最为重要、机制最为复杂的分子伴侣,广泛参与数百种蛋白质的折叠、活化或重组,几乎涵盖了所有基本的生物信号通路传导,因此被称为细胞内的“信号枢纽”。作为抗癌研究中的重要分子靶点,Hsp90的研究一直是国际科学界的热点。然而,由于Hsp90本身的动态特性以及它与底物蛋白的动态相互作用模式,相关复合体的结构信息一直非常匮乏,阻碍了我们对其功能机制的深入了解。
课题组首先对Hsp90与两种固有无序蛋白底物的动态相互作用进行了详尽研究,勾勒出了相互作用界面,并对其相互作用进行了定量表征。进一步研究发现,Hsp90通过其V字形双臂同时捕捉底物蛋白的两个疏水片段,整体的复合体构象展现出独特的“二分式(bipartite)”结合模式,即每个单体分子捕获底物的一个疏水结合区域。这种结合方式呈现出显著的协同效应:“1+1 ? 2”,大大延长了底物分子在Hsp90表面停留的时间 (图1)。研究进一步指出,该结合模式在从原核生物到真核生物不同种属的Hsp90中均高度保守。同时,核磁共振的动态学分析表明,底物蛋白在Hsp90的结合界面上仍保持高度的动态特性:每次被Hsp90捕捉后,它并没有被牢牢束缚,而是在Hsp90表面“翩翩起舞”,尝试多达10万次的构象调整,直到最终以活化的构象被释放出来。在此活化过程中,底物蛋白一直保持着无结构的松散状态,这也解释了为何Hsp90的数百种序列不同、结构迥异的底物都呈现出显著的热力学不稳定性。

图2. Hsp90的工作机制:一个由ATP赋能的“微型动态纳米机械夹钳”
本论文据此提出了分子伴侣Hsp90的工作机制,它犹如一个由ATP赋能的微型纳米机械夹钳,将ATP的化学能转化为开合的机械动能,为底物蛋白的折叠及活化提供了必要的动态环境(图2)。该研究为进一步加深了人们对于Hsp90动态分子机制的理解,为以该分子伴侣为抗癌药靶分子设计提供了新的思路。
0755-28715175/33164177